Για να εκτυπώσετε το Θέμα πατήστε "Εκτύπωση"!
| Τύπος Σχολείου: | Γενικό Λύκειο | Πηγή: Ι.Ε.Π. | Αναγνώσθηκε: 1123 φορές Επικοινωνία | |
|---|---|---|---|---|
| Μάθημα: | Χημεία | Τάξη: | Α' Λυκείου | |
| Κωδικός Θέματος: | 38800 | Θέμα: | 2 | |
| Τελευταία Ενημέρωση: | 13-Οκτ-2025 | Ύλη: | 1.3.1 Άτομα - Μόρια - Ιόντα 1.5.3 Διαλυτότητα 2.3.5 Ιοντικός ή ετεροπολικός δεσμός 2.3.6 Χαρακτηριστικά ιοντικών ή ετεροπολικών ενώσεων 2.3.7 Ομοιοπολικός δεσμός 2.3.8 Χαρακτηριστικά ομοιοπολικών ή μοριακών ενώσεων | |
| Το θέμα προέρχεται και αντλήθηκε από την πλατφόρμα της Τράπεζας Θεμάτων Διαβαθμισμένης Δυσκολίας που αναπτύχθηκε (MIS5070818-Tράπεζα θεμάτων Διαβαθμισμένης Δυσκολίας για τη Δευτεροβάθμια Εκπαίδευση, Γενικό Λύκειο-ΕΠΑΛ) και είναι διαδικτυακά στο δικτυακό τόπο του Ινστιτούτου Εκπαιδευτικής Πολιτικής (Ι.Ε.Π.) στη διεύθυνση (http://iep.edu.gr/el/trapeza-thematon-arxiki-selida) | ||||
| Τύπος Σχολείου: | Γενικό Λύκειο | ||
|---|---|---|---|
| Τάξη: | Α' Λυκείου | ||
| Μάθημα: | Χημεία | ||
| Θέμα: | 2 | ||
| Κωδικός Θέματος: | 38800 | ||
| Ύλη: | 1.3.1 Άτομα - Μόρια - Ιόντα 1.5.3 Διαλυτότητα 2.3.5 Ιοντικός ή ετεροπολικός δεσμός 2.3.6 Χαρακτηριστικά ιοντικών ή ετεροπολικών ενώσεων 2.3.7 Ομοιοπολικός δεσμός 2.3.8 Χαρακτηριστικά ομοιοπολικών ή μοριακών ενώσεων | ||
| Τελευταία Ενημέρωση: 13-Οκτ-2025 | |||
| Το θέμα προέρχεται και αντλήθηκε από την πλατφόρμα της Τράπεζας Θεμάτων Διαβαθμισμένης Δυσκολίας που αναπτύχθηκε (MIS5070818-Tράπεζα θεμάτων Διαβαθμισμένης Δυσκολίας για τη Δευτεροβάθμια Εκπαίδευση, Γενικό Λύκειο-ΕΠΑΛ) και είναι διαδικτυακά στο δικτυακό τόπο του Ινστιτούτου Εκπαιδευτικής Πολιτικής (Ι.Ε.Π.) στη διεύθυνση (http://iep.edu.gr/el/trapeza-thematon-arxiki-selida) | |||
Θέμα 2ο
2.1 Στο σχολικό εργαστήριο δίνονται στους μαθητές και μαθήτριες δύο λευκά κρυσταλλικά στερεά Α και Β. Η καθηγήτρια τούς ζητά να προσδιορίσουν με εργαστηριακές δοκιμές ποιο από τα δύο είναι ιοντική ένωση και ποιο ομοιοπολική.

α) Μια ομάδα μαθητών/τριών προτείνει να εξετάσει τους κρυστάλλους στο μικροσκόπιο, για να δει αν αποτελούνται από ιόντα ή μόρια. Συμφωνείτε ή διαφωνείτε με την πρόταση αυτή; Να εξηγήσετε την απάντησή σας.
(Μονάδες 4)
β) Μια άλλη ομάδα μαθητών/τριών προτείνει να παρασκευάσουν υδατικό διάλυμα της ένωσης Α και υδατικό διάλυμα της ένωσης Β και να προσδιορίσουν την αγωγιμότητά τους. Συμφωνείτε ή διαφωνείτε με την πρόταση αυτή; Να εξηγήσετε την απάντησή σας.
(Μονάδες 4)
γ) Μια τρίτη ομάδα μαθητών/τριών, αφού συμβουλεύτηκε τον παρακάτω πίνακα που αφορά τη διαλυτότητα διαφόρων ιοντικών & ομοιοπολικών χημικών ενώσεων σε \(g\) ανά \(100 mL\) νερού (στους \(30 °C\)), προτείνει να μελετήσουν τη διαλυτότητά τους στο νερό.
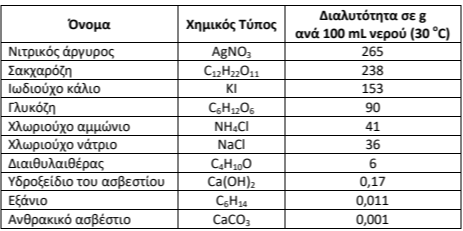
Η ένωση που θα διαλύεται περισσότερο σε \(100 mL\) νερού θα είναι σίγουρα η ιοντική. Συμφωνείτε ή διαφωνείτε με την πρόταση αυτή; Να εξηγήσετε την απάντησή σας.
(Μονάδες 4)
Μονάδες 12
2.2 Η Χριστίνα διάβασε σε ένα φυλλάδιο ότι το φθοριούχο μαγνήσιο (\(MgF_2\)) είναι συστατικό σε οδοντόκρεμες και ότι είναι λευκό στερεό με σημείο τήξεως \(1263 °C\). Πιο κάτω είδε ότι η αμμωνία (\(ΝΗ_3\)) είναι αέριο που εκπέμπεται από λιπάσματα και ζωικά απόβλητα. Αναρωτήθηκε: «γιατί το φθοριούχο μαγνήσιο να είναι στερεό και η αμμωνία να είναι αέριο;» Για να απαντήσετε στα ερωτήματα της Χριστίνας, θα χρειαστεί να αξιοποιήσετε γνώσεις Χημείας σχετικές με τον ιοντικό και τον ομοιοπολικό δεσμό.
α) Να περιγράψετε πώς σχηματίζεται ο δεσμός μεταξύ του \(_{12}Mg\) και του \(_9F\) στο φθοριούχο μαγνήσιο και να γράψετε τον χημικό του τύπο.
(Μονάδες 5)
β) Να περιγράψετε πώς σχηματίζεται ο δεσμός μεταξύ του \(_7Ν\) και του \(_1Η\) στην αμμωνία και να δώσετε τον σχετικό ηλεκτρονιακό τύπο.
(Μονάδες 4)
γ) Να αναφέρετε δύο βασικές διαφορές μεταξύ ιοντικού και ομοιοπολικού δεσμού.
(Μονάδες 4)
Μονάδες 13
Το παραπάνω θέμα αναπτύχθηκε στο πλαίσιο του έργου: «Ανάπτυξη Δοκιμασιών Αξιολόγησης Δεξιοτήτων Εγγραμματισμού στα μαθήματα της Νεοελληνικής Γλώσσας και Λογοτεχνίας, της Άλγεβρας, της Φυσικής και της Χημείας Α’ Λυκείου Γενικού Λυκείου» Ανάδοχος: «Ειδικός Λογαριασμός Κονδυλίων Έρευνας (Ε.Λ.Κ.Ε) Πανεπιστημίου Ιωαννίνων» ΑΔΑΜ: 25SYMV016348911 2025-02-20.
Ενδεικτικές απαντήσεις
2.1
α) Διαφωνούμε. Τα μόρια και τα ιόντα είναι πάρα πολύ μικρά και δεν φαίνονται στο μικροσκόπιο (επίσης, ο τρόπος κρυστάλλωσης επηρεάζεται και από άλλους παράγοντες π.χ. υγρασία, θερμοκρασία, όχι μόνο από τη φύση του δεσμού).
β) Συμφωνούμε. Η αγωγιμότητα ενός υδατικού διαλύματος εξαρτάται από την παρουσία ελεύθερων ιόντων σε αυτό. Στο νερό οι ιοντικές ενώσεις διαλύονται και διίστανται σε ιόντα, οπότε τα διαλύματά τους άγουν το ηλεκτρικό ρεύμα. Αντίθετα, οι ομοιοπολικές ενώσεις (όπως η σακχαρόζη) δίνουν, εν γένει, μοριακά διαλύματα, που δεν άγουν το ηλεκτρικό ρεύμα.
(Υπάρχουν κάποιες ομοιοπολικές ενώσεις που είναι κρυσταλλικά στερεά και ιοντίζονται μερικώς σε υδατικό διάλυμα, όπως το κιτρικό οξύ ή το τρυγικό οξύ, οπότε έχουν κάποια αγωγιμότητα αλλά πολύ μικρότερη από αυτή που έχει ένα ευδιάλυτο ιοντικό στερεό.)
γ) Διαφωνούμε. Όπως φαίνεται και στον πίνακα, η διαλυτότητα στο νερό δεν αποτελεί ασφαλές κριτήριο για να διακρίνουμε ιοντικές από ομοιοπολικές ενώσεις. Υπάρχουν ιοντικές ενώσεις που είναι δυσδιάλυτες (π.χ. \(CaCO_3\)) και ομοιοπολικές ενώσεις που είναι εξαιρετικά διαλυτές (π.χ. σακχαρόζη, γλυκόζη). Άρα η ποσότητα που διαλύεται δεν είναι επαρκής ένδειξη για τον τύπο δεσμού.
2.2
α) \(_{12}Μg\): \(Κ(2) L(8) Μ(2)\). Είναι μέταλλο και έχει την τάση να αποβάλει \(2\) ηλεκτρόνια για να μείνει με τη στιβάδα \(L\) συμπληρωμένη με \(8\) ηλεκτρόνια.
\(_9F\): \(Κ(2) L(7)\). Είναι αμέταλλο και έχει την τάση να προσλάβει \(1\) ηλεκτρόνιο για να αποκτήσει εξωτερική στιβάδα με \(8\) ηλεκτρόνια.
Μέταλλο με αμέταλλο θα κάνουν ιοντικό δεσμό.
Για να δώσει \(2\) ηλεκτρόνια το άτομο του μαγνησίου, θα χρειαστεί \(2\) άτομα φθορίου, όπως φαίνεται στο σχήμα.
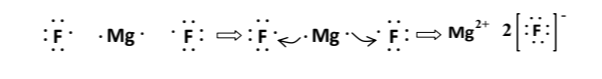
β) \(_1Η\): \(Κ(1)\). Είναι αμέταλλο και έχει την τάση να προσλάβει \(1\) ηλεκτρόνιο για να συμπληρώσει την εξωτερική του στιβάδα (η \(Κ\) συμπληρώνεται με \(2\) ηλεκτρόνια).
\(_7Ν\): \(Κ(2) L(5)\). Είναι αμέταλλο και έχει την τάση να προσλάβει \(3\) ηλεκτρόνια για να συμπληρώσει την εξωτερική του στιβάδα.
Δύο αμέταλλα θα κάνουν ομοιοπολικό δεσμό.
Για να συνεισφέρει \(3\) ηλεκτρόνια το άτομο του αζώτου και να δημιουργηθούν \(3\) κοινά ζεύγη, θα χρειαστεί \(3\) άτομα υδρογόνου, όπως φαίνεται στο σχήμα.
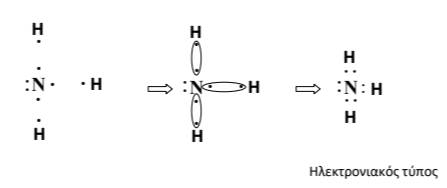
(Χημικός Τύπος: \(NH_3\))
γ) Οποιεσδήποτε δύο από τις ακόλουθες:
- Ο ιοντικός δεσμός σχηματίζεται μεταξύ ενός μετάλλου (στοιχείου δηλαδή που έχει την τάση να αποβάλλει ηλεκτρόνια) και ενός αμετάλλου (στοιχείου δηλαδή που έχει την τάση να προσλαμβάνει ηλεκτρόνια), ενώ ο ομοιοπολικός ανάμεσα σε δύο αμέταλλα.
- Στον ιοντικό δεσμό έχουμε αποβολή και πρόσληψη ηλεκτρονίων (ή μεταφορά ηλεκτρονίων), ενώ στον ομοιοπολικό αμοιβαία συνεισφορά ηλεκτρονίων.
- Ο ιοντικός δεσμός οφείλεται στις έλξεις μεταξύ των αντίθετα φορτισμένων ιόντων, ενώ ο ομοιοπολικός στις έλξεις από το κοινό ή τα κοινά ζεύγη ηλεκτρονίων.
- Στον ιοντικό έχουμε δημιουργία ιοντικού κρυσταλλικού πλέγματος, ενώ στον ομοιοπολικό δημιουργία μορίων.
